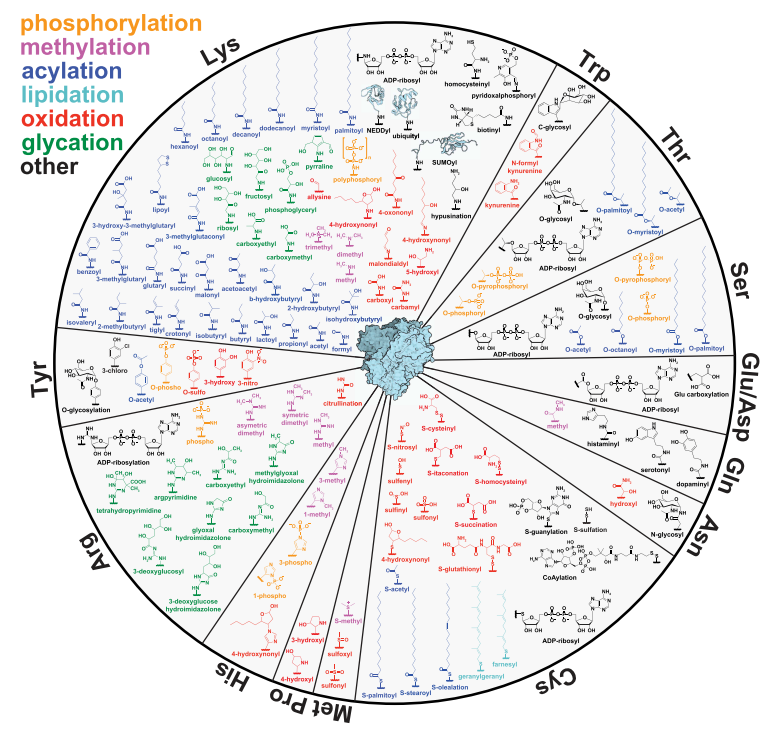
人類基因組包含約2萬到2.5萬個蛋白質編碼基因。然而,人類體內的蛋白質種類卻遠多于基因數量,估計在20萬到200萬之間。從基因到mRNA再到蛋白質,多樣性的產生是一個多層次、多機制的過程。這些機制包括基因水平的變異(如突變、融合、重復)、轉錄水平的調控(如選擇性剪接、轉錄起始位點的選擇、轉錄終止位點的選擇、非編碼RNA的調控)以及翻譯后修飾(如磷酸化、泛素化、乙酰化、糖基化、脂質化、氧化修飾)。這些機制相互協作,極大地豐富了蛋白質的結構和功能多樣性,從而支持了生物體的復雜生理功能和適應能力。 一、蛋白翻譯后修飾的定義與概述 蛋白翻譯后修飾是指在蛋白質合成后,通過共價鍵連接的方式在氨基酸殘基上添加各種化學基團,或者對蛋白質進行剪切、折疊等加工過程,從而改變蛋白質的結構、穩定性、活性、定位以及與其他分子相互作用的能力。這些修飾過程通常發生在細胞質、內質網、高爾基體等細胞器中,由一系列高度特異性的酶來催化完成。目前已知的蛋白翻譯后修飾類型繁多,包括磷酸化、泛素化、乙酰化、甲基化、糖基化、泛素樣蛋白修飾、脂質化、氧化修飾等。每種修飾都有特殊的其生物學意義和作用機制,它們相互協作,形成了一個復雜而精細的調控網絡,精確地調控著蛋白質的功能和細胞的生理活動。
二、常見的蛋白翻譯后修飾類型及其功能 (一)磷酸化(Phosphorylation) 磷酸化是蛋白質最常見的翻譯后修飾之一,主要發生在絲氨酸(Ser)、蘇氨酸(Thr)和酪氨酸(Tyr)殘基上。磷酸化修飾通常由蛋白激酶催化,通過將 ATP 分子上的磷酸基團轉移到特定的氨基酸殘基上,從而改變蛋白質的結構和功能。磷酸化修飾在細胞信號轉導中起著核心作用,它可以調節蛋白質的活性、穩定性、亞細胞定位以及與其他蛋白質的相互作用。例如,在細胞生長、分化、凋亡、代謝調節等過程中,許多關鍵的信號通路依賴于蛋白質的磷酸化修飾來傳遞和放大信號。當細胞外信號分子(如激素、生長因子等)與細胞表面受體結合后,會激活一系列的蛋白激酶級聯反應,通過磷酸化修飾將信號從受體傳遞到細胞內,最終導致細胞內靶蛋白的活性改變,引發相應的細胞反應。此外,磷酸化修飾還參與基因表達調控,一些轉錄因子在磷酸化后能夠結合到 DNA 上,調節基因的轉錄活性。作為研究很廣泛的翻譯后修飾類型之一,磷酸化的檢測抗體現在也比較常見。
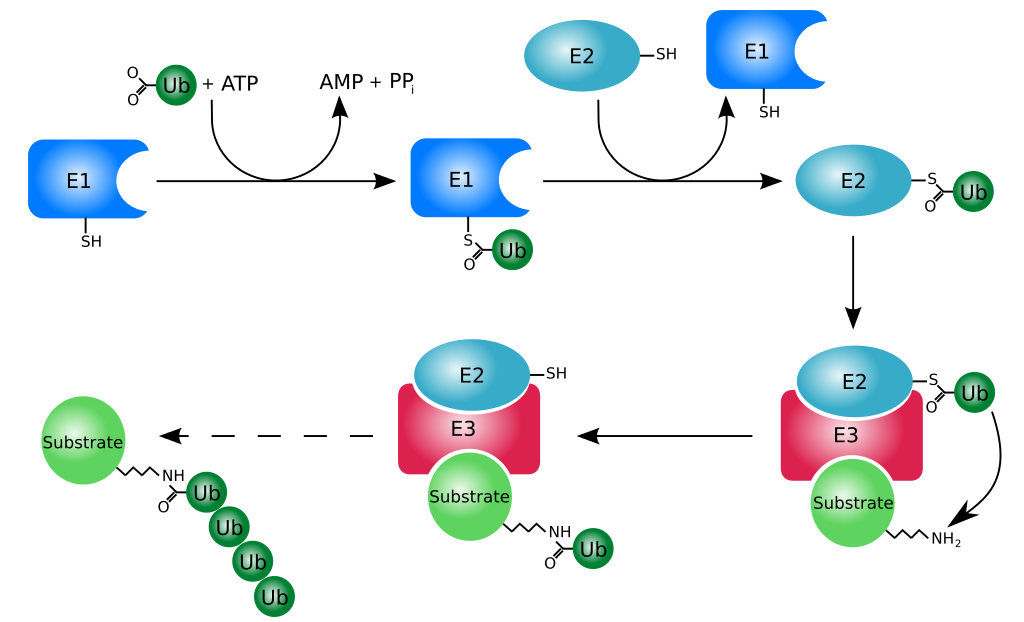
(二)泛素化(Ubiquitination) 泛素化修飾是將泛素分子共價連接到目標蛋白質上的過程,主要通過泛素激活酶(E1)、泛素結合酶(E2)和泛素連接酶(E3)的協同作用完成。泛素化修飾在蛋白質降解、細胞周期調控、DNA 修復、信號轉導等多個生物學過程中發揮著關鍵作用。最典型的功能是通過多泛素鏈的形成,標記目標蛋白質進入蛋白酶體降解途徑,從而調節蛋白質的水平和細胞內的穩態。例如,在細胞周期的各個階段,許多細胞周期蛋白通過泛素化修飾被蛋白酶體降解,確保細胞周期的正常進行。此外,泛素化修飾還可以調節蛋白質的亞細胞定位、活性以及與其他蛋白質的相互作用,參與細胞內多種信號通路的調控,如 NF-κB 信號通路、Wnt 信號通路等。
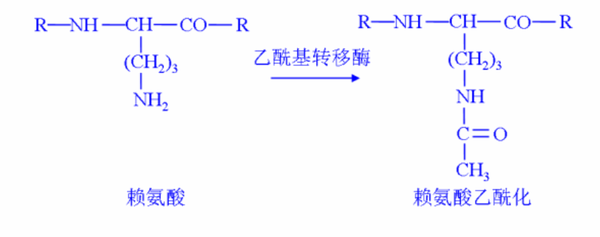
(三)乙酰化(Acetylation) 乙酰化修飾主要發生在賴氨酸殘基上,由乙酰轉移酶催化,將乙酰輔酶 A 上的乙酰基團轉移到賴氨酸殘基的氨基上。乙酰化修飾在基因表達調控、染色質結構重塑、細胞代謝、蛋白質穩定性等方面具有重要作用。在基因表達調控中,組蛋白乙酰化是一種重要的表觀遺傳修飾方式,乙酰化修飾可以中和組蛋白的正電荷,減弱組蛋白與 DNA 的結合,使染色質結構變得松散,從而促進轉錄因子和 RNA 聚合酶等轉錄相關因子與 DNA 的結合,激活基因的轉錄。除了組蛋白外,許多非組蛋白也存在乙酰化修飾,這些修飾可以調節蛋白質的活性、穩定性、亞細胞定位以及與其他蛋白質的相互作用,參與細胞內的多種代謝過程和信號轉導通路。
(四)糖基化(Glycosylation) 糖基化修飾是指將糖基團連接到蛋白質上的過程,主要分為 N - 糖基化和 O - 糖基化兩種類型。N - 糖基化修飾發生在天冬酰胺殘基上,而 O - 糖基化修飾則主要發生在絲氨酸、蘇氨酸或羥賴氨酸殘基上。糖基化修飾在蛋白質的折疊、穩定性、亞細胞定位、細胞間識別和信號轉導等方面發揮著重要作用。在蛋白質折疊過程中,糖基化修飾可以分子作為伴侶,幫助蛋白質正確折疊,防止蛋白質聚集。糖基化修飾還可以調節蛋白質的穩定性,影響蛋白質在細胞內的運輸和亞細胞定位。在細胞間識別和信號轉導方面,細胞表面的糖蛋白通過其糖基化修飾與細胞外的配體、受體或細胞間基質相互作用,參與細胞 - 細胞間的粘附、免疫識別、細胞遷移等過程。例如,在免疫系統中,抗體的糖基化修飾可以影響其與抗原的結合親和力和免疫效應功能。
三、蛋白翻譯后修飾的調控機制 蛋白翻譯后修飾的調控是一個復雜的過程,涉及到多種因素的相互作用。首先,修飾酶和去修飾酶的活性是調控蛋白翻譯后修飾的關鍵因素。修飾酶和去修飾酶的表達水平、活性狀態以及它們與底物的結合親和力都會影響蛋白翻譯后修飾的程度。例如,蛋白激酶和磷酸酶的活性平衡決定了蛋白質的磷酸化水平;乙酰轉移酶和去乙酰化酶的活性平衡則決定了蛋白質的乙酰化水平。其次,細胞內的信號轉導通路也會對蛋白翻譯后修飾進行調控。細胞外的信號分子通過激活特定的信號通路,可以調節修飾酶和去修飾酶的活性,從而改變蛋白質的翻譯后修飾狀態。例如,生長因子激活的 PI3K - Akt 信號通路可以調節蛋白激酶的活性,進而影響蛋白質的磷酸化修飾。此外,細胞內的代謝狀態、氧化還原狀態等也會對蛋白翻譯后修飾產生影響。例如,細胞內的能量代謝狀態可以影響乙酰輔酶 A 的水平,進而調節乙酰化修飾的程度;氧化應激可以誘導蛋白質的氧化修飾,如酪氨酸硝化、半胱氨酸氧化等。 四、蛋白翻譯后修飾的研究方法與技術 隨著生物技術的不斷發展,研究蛋白翻譯后修飾的方法和技術也越來越多樣化。傳統的研究方法包括免疫沉淀、免疫印跡、質譜分析等。免疫沉淀和免疫印跡技術可以用于檢測特定蛋白質的翻譯后修飾狀態,通過特性的異抗體識別和結合修飾后的蛋白質,從而實現對蛋白質修飾的定性和定量分析。近年來,隨著蛋白質組學技術的不斷發展,基于質譜的蛋白質組學技術已成為研究蛋白翻譯后修飾的強大工具。通過高通量的蛋白質組學分析,可以同時鑒定和定量分析細胞或組織中大量蛋白質的翻譯后修飾狀態,揭示蛋白質修飾的全局性變化和調控網絡。 WB示例:
Primary antibody: Phospho-NF-kB p105/p50 (Ser337) Recombinant Rabbit mAb at 1/5000 dilution CoIP示例: 利用目的蛋白抗體富集出總蛋白之后用修飾泛抗體檢測富集后蛋白的翻譯后修飾或利用修飾泛抗體富集出修飾的所有蛋白,再用目的蛋白抗體檢測該蛋白的翻譯后修飾。
參考文獻: |
貨號 | 產品名稱 | 規格 |
abs955 | 免疫(共)沉淀(IP/CoIP)試劑盒 | 50T |
abs9649 | 免疫(共)沉淀(IP/CoIP)試劑盒(磁珠法) | 50T |
abs160027 | Anti-GST Agarose Beads | 125uL(5reactions) |
abs160026 | Anti-Myc Tag Agarose Beads | 125uL(5reactions) |
abs160022 | Anti-RFP/mcherry Agarose Beads | 125uL(5reactions) |
abs111870 | Rabbit anti-5-hydroxymethylcytosine Polyclonal Antibody | 50uL |
abs118910 | Rabbit anti-Acetyl-Histone H3-K27 Polyclonal Antibody | 50uL |
abs149356 | Rabbit anti-Histone H2A(Butyryl-K5) Polyclonal Antibody | 50uL |
abs149363 | Rabbit anti-Histone H3(MonoMethyl-K9) Polyclonal Antibody | 50uL |
abs20213 | Mouse anti-Rabbit IgG-HRP Antibody(Conformation Specific) | 50uL |
abs20212 | Rat anti-Mouse lgG-HRP Antibody(Conformation Specific) | 50uL |
Absin文獻獎勵重磅升級!
Absin產品線:
爆款產品:試劑盒(mIHC、IHC、凋亡、ELISA、ChIP、Co-IP、TR-FRET、生化檢測、殘留檢測、多因子檢測);細胞培養(類器官試劑盒+基質膠,胎牛血清+培養添加劑+細胞因子)、分化試劑盒;分子(mRNA合成服務+提取試劑盒);化合物大包裝;輔助試劑、耗材/儀器、定制服務(抗體/多肽/蛋白/標記/檢測)...
特色產品:雞胚提取物CEE、B27、N2、霍亂毒素B亞單位CTB、牛腦垂體提取物BPE、百日咳毒素PTX、重組人胰島素Insulin、人源低密度脂蛋白LDL...
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號


















 采購中心
采購中心