無細胞蛋白表達:突破傳統(tǒng)瓶頸,解鎖3大高難度蛋白應(yīng)用場景
膜蛋白結(jié)構(gòu)解析卡在表達階段?
非天然氨基酸標記總失敗?
蛋白表達通量太低?
毒蛋白無法表達?
無細胞蛋白表達技術(shù)正在顛蛋白生產(chǎn)困境,為科研與產(chǎn)業(yè)帶來全新可能。
一、技術(shù)革新:無細胞蛋白表達技術(shù)
無細胞蛋白質(zhì)合成 (CFPS) 系統(tǒng)是一項創(chuàng)新技術(shù),具有廣泛的潛在應(yīng)用。在基礎(chǔ)科學(xué)和應(yīng)用科學(xué)中,CFPS系統(tǒng)是分子生物學(xué)家的重要媒介。與活細胞中的蛋白質(zhì)表達相比,它具有許多優(yōu)勢,并且更頻繁地用于高通量功能基因組學(xué)和蛋白質(zhì)組學(xué)。在創(chuàng)建核酸可編程蛋白陣列 (NAPPA) 等蛋白質(zhì)陣列或使用顯示技術(shù)創(chuàng)建工程酶時,CFPS 系統(tǒng)非常重要。連接基因型和表型 (表達蛋白的功能) 的主要方法是通過無細胞法。此外,CFPS 系統(tǒng)對于有毒、膜結(jié)合、病毒性且易受細胞內(nèi)蛋白酶介導(dǎo)的快速蛋白水解破壞的蛋白質(zhì)的表達至關(guān)重要。下面將從幾個方面對比CFPS和傳統(tǒng)細胞表達形式。
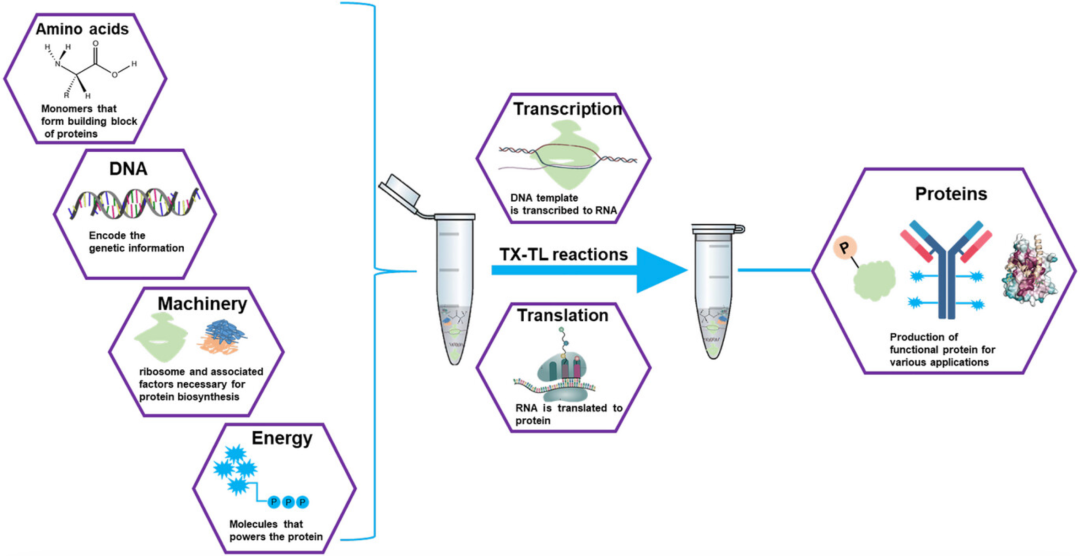
圖1:反應(yīng)所需的無細胞蛋白合成 (CFPS) 系統(tǒng)組分的圖示
1.表達階段對比

2.下游處理對比

二、核心應(yīng)用場景與案例
場景1:全長跨膜蛋白生產(chǎn)——藥物靶點開發(fā)的"鑰匙"
跨膜蛋白 (TMP) 位于不同的膜中,它們在細胞或細胞器的內(nèi)側(cè)和外側(cè)之間提供門。人類蛋白質(zhì)組中大約 25% 的編碼蛋白包含一個或多個膜區(qū)域。全長跨膜蛋白作為細胞信號傳遞和物質(zhì)交換的核心載體,是目前最主要的藥物靶點,占現(xiàn)階段已知藥物靶點的60%以上。然而,全長膜蛋白難溶于水、易聚集失活,是蛋白表達中的難點。基于細胞表達往往效果不好;采用如VLP等方法時雖然能得到全長膜蛋白,但是不相干雜蛋白干擾過大;采用膜蛋白胞外區(qū)截斷的方法在蛋白性能上的風(fēng)險有較大隱憂。而無細胞蛋白表達技術(shù),則可以高成功率、高純度、高活性的表達全長膜蛋白。
珀羅汀生物案例:全長CLDN 18.1膜蛋白可溶表達
實驗人員構(gòu)建了融合標簽的CLDN 18.1質(zhì)粒,選用合適的珀羅汀無細胞表達條件體系,進行表達。通過在無細胞反應(yīng)體系中加入表面活性劑,實現(xiàn)CLDN 18.1的可溶表達。經(jīng)純化,成功獲得80%以上純度的CLDN 18.1蛋白。下游活性驗證實驗表明,CLDN 18.1蛋白具有良好的生物學(xué)活性!
(詳情鏈接:明星膜蛋白CLDN 18.1新合成路線:無細胞系統(tǒng)全長蛋白表達
此外我司基于自主知識產(chǎn)權(quán)的無細胞蛋白表達技術(shù),已成功表達多種單次、四次、七次全長跨膜蛋白,表達成功率接近100%!
場景2:難度蛋白表達生產(chǎn)—突破蛋白結(jié)構(gòu)研究的“限制”
某些蛋白質(zhì)因其特殊的結(jié)構(gòu)特征和理化性質(zhì),被歸為難表達蛋白,它們不僅是基礎(chǔ)科學(xué)的重要課題,更是藥物開發(fā)、結(jié)構(gòu)生物學(xué)和生物制造的瓶頸問題。在傳統(tǒng)表達體系中難表達蛋白往往面臨產(chǎn)量低、活性差等問題,它們的表達障礙主要源于三個層面的限制:
1.分子層面,如含有密集二硫鍵網(wǎng)絡(luò)或復(fù)雜四級結(jié)構(gòu)的蛋白(如抗體Fab片段、多亞基酶復(fù)合體),極易在折疊過程中發(fā)生構(gòu)象錯誤,形成無活性的包涵體;
2.細胞層面,疏水性強的跨膜蛋白或依賴特定糖基化修飾的功能蛋白(如GPCRs、凝血因子Ⅶ),難以在普通宿主細胞中維持其天然構(gòu)象;
3.生理層面,具有細胞毒性的蛋白(如溶菌酶)會直接干擾宿主細胞的正常代謝,造成表達系統(tǒng)崩潰。此外,培養(yǎng)環(huán)境的細微變化(如氧化還原電位波動、分子伴侶缺失)都可能引發(fā)蛋白的錯誤加工或降解,進一步降低表達成功率。
珀羅汀生物案例:毒蛋白生產(chǎn)
依托PLD無細胞快速表達技術(shù),成功表達出BamHI限制性內(nèi)切酶。通過在質(zhì)粒中加入PLD無細胞蛋白表達的BamHI限制性內(nèi)切酶,濃度分別為0、0.001、0.0015、0.015、0.15 ug/uL,37℃酶切1h,驗證酶活性。實驗證明PLD無細胞蛋白表達的BamHI限制性內(nèi)切酶具有活性,低濃度為 0.001 ug/uL即可顯示酶切活性。
詳情鏈接:無細胞蛋白表達——難度蛋白表達“急救包”
此外,我司無細胞蛋白表達平臺已成功用于合成各種分子量的蛋白質(zhì),從單結(jié)構(gòu)域到多結(jié)構(gòu)域、單個亞基到多亞基蛋白復(fù)合體,分子量從10 kDa到160 kDa,PLD無細胞蛋白表達系統(tǒng)都能勝任,并得到活性驗證。
場景3:高通量篩選——抗體優(yōu)化的"全自動工廠"
在抗體藥物研發(fā)中,高通量篩選(HTS)已成為縮短開發(fā)周期、提升抗體性能的核心技術(shù)。然而,傳統(tǒng)細胞表達系統(tǒng)的局限性,使得這一過程仍面臨效率與成本的博弈。比如現(xiàn)代抗體工程(如噬菌體展示、單B細胞測序)可生成數(shù)百萬種候選序列,但傳統(tǒng)細胞表達僅能逐批測試,耗時數(shù)月。抗體需同時滿足親和力、穩(wěn)定性、可溶性、低免疫原性等要求,傳統(tǒng)方法需分步測試。
珀羅汀生物案例:打造高通量無細胞蛋白表達工作站
我司打造的高通量無細胞蛋白表達工作站,實現(xiàn)抗體篩選技術(shù)的革命性突破!該平臺具備三大優(yōu)勢:
超高通量篩選能力:每日可完成3000個抗體的自動化篩選,將傳統(tǒng)以周/月為單位的篩選周期壓縮至24小時內(nèi),真正實現(xiàn)"今日設(shè)計-明日驗證"的研發(fā)新范式。
全流程無人化操作:從DNA模板到功能抗體的全自動合成系統(tǒng),支持線性化DNA片段直接表達,數(shù)小時內(nèi)表達候選抗體,全程無需人工干預(yù)和純化步驟。
全抗體類型兼容:突破性解決二硫鍵正確配對難題,可高效表達從VHH、scFv等小分子片段到Fab、全長抗體的所有類型。
詳情鏈接:抗體篩選“天選”模式,日篩抗體三千個
結(jié)語
在生命科學(xué)研究和藥物開發(fā)中,蛋白表達技術(shù)始終是突破創(chuàng)新的核心驅(qū)動力。無細胞蛋白表達技術(shù)以其快速、靈活、高效的優(yōu)勢,正在重塑傳統(tǒng)蛋白研究的邊界——無論是結(jié)構(gòu)復(fù)雜的全長膜蛋白、傳統(tǒng)系統(tǒng)難以駕馭的高難度蛋白,還是需要精準修飾的非天然氨基酸插入蛋白,都能通過這一技術(shù)獲得突破性進展。
參考文獻
1.Maharjan A, Park JH. Cell-free protein synthesis system: A new frontier for sustainable biotechnology-based products. Biotechnol Appl Biochem. 2023;70(6):2136-2149. doi:10.1002/bab.2514.
2.Dobson L, Tusnády GE. MemDis: Predicting Disordered Regions in Transmembrane Proteins. Int J Mol Sci. 2021;22(22):12270. Published 2021 Nov 12. doi:10.3390/ijms222212270.
3.Chen JP, Gong JS, Su C, Li H, Xu ZH, Shi JS. Improving the soluble expression of difficult-to-express proteins in prokaryotic expression system via protein engineering and synthetic biology strategies [published online ahead of print, 2023 May 25]. Metab Eng. 2023;78:99-114. doi:10.1016/j.ymben.2023.05.007.
4.Manzer ZA, Selivanovitch E, Ostwalt AR, Daniel S. Membrane protein synthesis: no cells required. Trends Biochem Sci. 2023 Jul;48(7):642-654.
相關(guān)產(chǎn)品
免責(zé)聲明
- 凡本網(wǎng)注明“來源:化工儀器網(wǎng)”的所有作品,均為浙江興旺寶明通網(wǎng)絡(luò)有限公司-化工儀器網(wǎng)合法擁有版權(quán)或有權(quán)使用的作品,未經(jīng)本網(wǎng)授權(quán)不得轉(zhuǎn)載、摘編或利用其它方式使用上述作品。已經(jīng)本網(wǎng)授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來源:化工儀器網(wǎng)”。違反上述聲明者,本網(wǎng)將追究其相關(guān)法律責(zé)任。
- 本網(wǎng)轉(zhuǎn)載并注明自其他來源(非化工儀器網(wǎng))的作品,目的在于傳遞更多信息,并不代表本網(wǎng)贊同其觀點和對其真實性負責(zé),不承擔(dān)此類作品侵權(quán)行為的直接責(zé)任及連帶責(zé)任。其他媒體、網(wǎng)站或個人從本網(wǎng)轉(zhuǎn)載時,必須保留本網(wǎng)注明的作品第一來源,并自負版權(quán)等法律責(zé)任。
- 如涉及作品內(nèi)容、版權(quán)等問題,請在作品發(fā)表之日起一周內(nèi)與本網(wǎng)聯(lián)系,否則視為放棄相關(guān)權(quán)利。
 手機版
手機版 化工儀器網(wǎng)手機版
化工儀器網(wǎng)手機版
 化工儀器網(wǎng)小程序
化工儀器網(wǎng)小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關(guān)注視頻號
掃碼關(guān)注視頻號


















 采購中心
采購中心