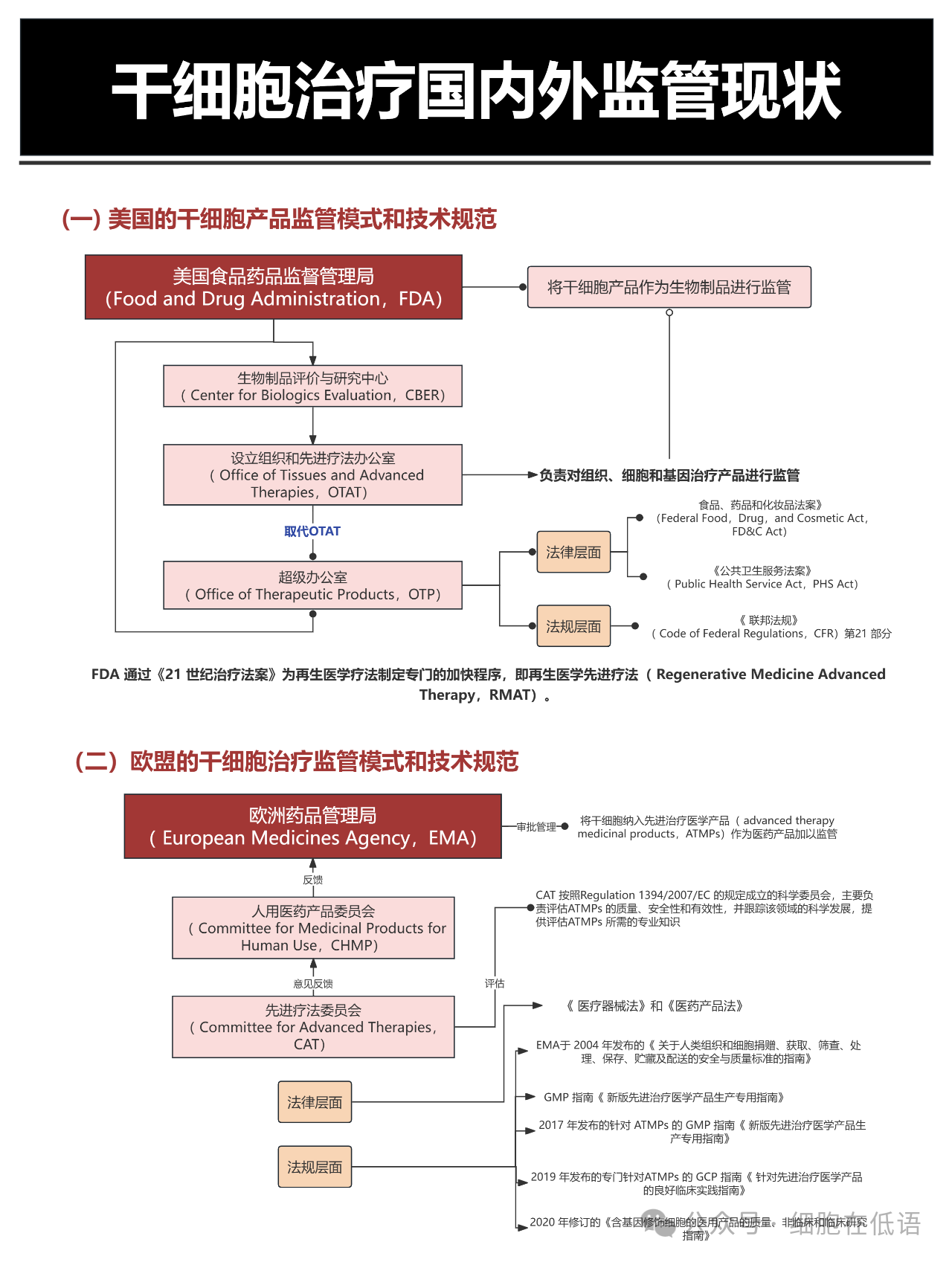
本文聚焦干細胞治療這一前沿醫療領域的國內外監管現狀,深入解析美國、歐盟、日本、中國四國的監管體系特點。在美國,食品藥品監督管理局(FDA)將干細胞明確歸類為生物制品,通過 “再生醫學先進療法”(RMAT)加速程序,在保障安全性的前提下縮短創新療法的審批周期。歐盟則由歐洲藥品管理局(EMA)主導,將干細胞治療納入先進治療醫學產品(ATMPs)框架,聯合細胞治療委員會(CAT)等專業機構開展多維度評估,強調技術創新性與臨床價值的平衡。
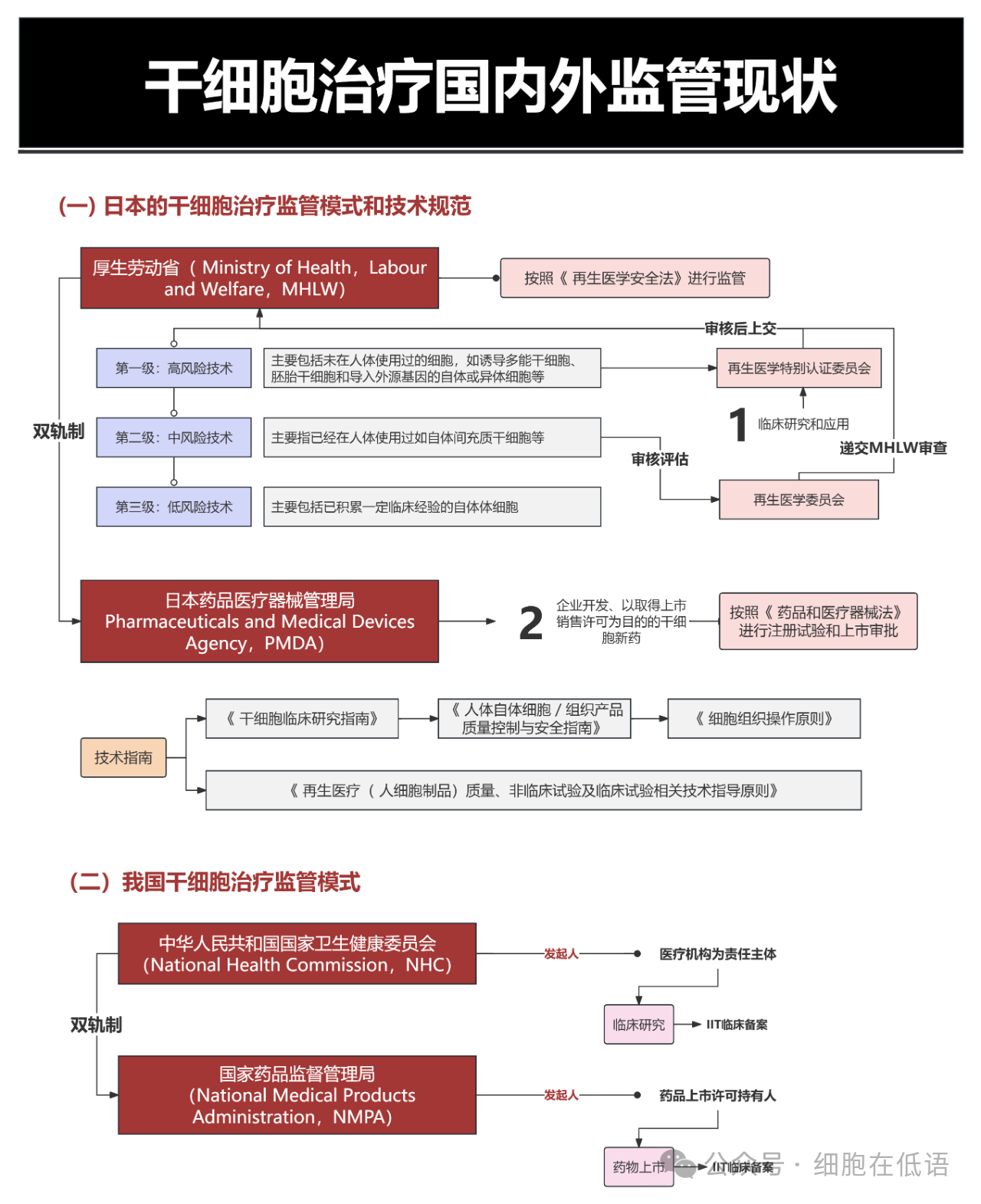
日本采用厚生勞動省與藥品和醫療器械局(PMDA)的雙軌監管模式,根據干細胞療法的風險等級實施分級管控,為再生醫學發展提供靈活空間。我國實行國家衛生健康委員會(NHC)負責臨床研究審批、國家藥品監督管理局(NMPA)主管藥物上市許可的雙軌制,清晰劃分醫療機構與藥企的責任邊界。盡管各國監管路徑各有側重,但均以規范行業發展、保障患者權益為核心,共同推動干細胞治療向標準化、產業化方向邁進。
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號



















 采購中心
采購中心